আমরা জানি ১ মোল কোন পদার্থে অ্যাভোগেড্রো সংখ্যক কণা থাকে। অ্যাভোগেড্রো সংখ্যার মান হল 6.02×10^23।
কিন্তু এই সংখ্যাটির মান কেনো এই নির্দির্ষ্ট সংখ্যাটিই হল? অন্য কোন মান হতে পারলো না? এই ব্যাপারটি আজকের পোস্টের আলোচ্য বিষয়।
আমরা জানি হাইড্রোজেনের (H) এর পারমাণবিক ভর 1.008 g. এটা পাওয়া যায় হাইড্রোজেনের প্রধান তিনটি আইসোটোপের গড় ভর থেকে। এখন হাইড্রোজেন পরমাণুর নিক্লিয়াসে সাধারণত একটিমাত্র প্রোটন থাকে, কোন নিউট্রন থাকে না। তাহলে একটি H পরমাণুর ভর আসলে এর পরমাণুর কেন্দ্রের প্রোটনটির ভরের সমান (কক্ষপথস্থ ইলেক্ট্রনের ভর অতিমাত্রায় নগণ্য বলে হিসাব-বহির্ভূত।
অর্থ্যাত ১ টি H পরমাণুর ভর = ১ টি প্রোটনের ভর। = 1.672 × 10^-24 g।
এখন আমরা বের করব, এরকম কতগুলো H-পরমাণুর সমন্বিত ভর 1.008 g হয়।
গাণিতিকভাবে, (ঐকিক নিয়ম)
ভর 1.672 × 10^-24 g হয় যখন কণা 1 টি
ভর 1 হয় যখন কণা 1/(1.672 × 10^-24 g) টি
ভর 1.008 g হয় যখন কণা 1.008 g/(1.672 × 10^-24 g) টি
≈6.02×10^23 টি।
অর্থ্যাত 6.02×10^23 টি H-পরমাণু নিলে আমরা 1.008 g H পাব। অন্য কোন মৌল থেকেও হিসেব করে আমরা এই সংখ্যা পেতে পারি।
তাহলে, মূলত আমরা যে বলি হাইড্রোজেনের পারমাণবিক ভর 1.008 g, এটা আসলে ১ মোল বা 6.02×10^23 সংখ্যক হাইড্রজেন পরমাণুর ভর। নচেৎ, একটি H-পরমাণুর ভর তো সেই শধু প্রোটনটির ভরের সমান মানে 1.672 × 10^-24 g।
অবশ্য, এখানে আমরা যাকে পারমাণবিক ভর বলছি তা মূলত গ্রাম পারমাণবিক ভর।
পারমাণবিক ভরকে মূলত Atomic Mass Unit (a.m.u) এককে প্রকাশ করা হয়। সেক্ষত্রে সেটা একটি পরমাণুরই ভর, অ্যাভোগেড্রো সংখ্যক কণার ভর নয়।


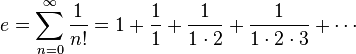


2 মন্তব্য(গুলি)
Write মন্তব্য(গুলি)thanks for your answer
Replyঅন্য পৱমানু দিয়ে দেখালে completly clear hoia jeto
Reply