পারমাণবিক ভর ও ভর সংখ্যা কাছাকাছি সংখ্যা হলেও একই জিনিস নয়।
পারমাণবিক ভর ( বা পারমাণবিক ওজন, রসায়নে দুটিই বলা হয়, যদিও ফিজিক্সের ভাষায় বিদ্ঘুটে লাগছে! ) হচ্ছে, " কোন মৌলের প্রকৃতিতে প্রাপ্ত অ-তেজস্ক্রিয় আইসোটপগুলোর গড় ভর"।
অন্যদিকে ভর সংখ্যা হল পরমাণূর নিউক্লিয়াসে উপস্থিত নিউক্লিয়নের সংখ্যা ( প্রোটন+ নিউট্রন)
পারমাণবিক ভরের হিসাবঃ
প্রত্যেকটি আইসোটপের প্রাচুর্যতার শতকরা থেকে এটা হিসাব করা হয়। এটা সাধারণত দশমিক বিশিষ্ট সংখ্যা হয়, একেই পর্যায় সারণীতে মৌলের সাথে লেখা হয়।
আইসোটপদের প্রাচুর্যতার পারসেন্টেজকে তাদের নিজ নিজ ভর দ্বারা গুণ করে প্রাপ্ত সমষ্টিই হচ্ছে পারমাণবিক ভর।
তাহলে,
পারমাণবিক ভর = m1 × x1+ m2 × x2+m3 × x3+….+mn × xn
যেখানে ,
m1= প্রথম আইসোটপের ভর
x1 = প্রথম আইসোটপের প্রাচুর্যতা/ 100 ইত্যাদি
যেমন হাইড্রোজনের তিনটি প্রধান আইসোটপ 1H, 2H, এবং 3H। এদের প্রত্যেকের ভর সংখ্যা ভিন্ন।
প্রথমটিতে ১ টি প্রোটন আছে, কোন নিউট্রন নেই, তাই ভর সংখ্যা = (১+০)= ১
২য় টিতে ১ টি প্রোটন ও ১ টি নিউট্রন আছে। তাই ভরসংখ্যা (১+১) = ২।
একইভাবে ৩য় টির ভর সংখ্যা = ৩।
হাইড্রজনের মধ্যে ৯৯.৯৮ % হচ্ছে 1H, .০১৮% হচ্ছে 2Hএবং .০০২% হচ্ছে 3H।
উপরের সূত্রানুযায়ী হিসেব করলে উত্তর আসবে 1.0079 g/mol ।
প্রসঙ্গত, এখানে প্রাপ্ত পারমাণবিক ভর টি হল এক মোল পরিমাণ পদার্থের। তার মানে অ্যাভোগেড্রো সংখ্যক কণার বা 6.022×1023 গুলো কণার। একটি পরমাণূর ভর বের করতে হলে পারমানবিক ভরকে অ্যাভোগেড্রো সংখ্যা দ্বারা ভাগ দিতে হবে।
পারমাণবিক ভর ( বা পারমাণবিক ওজন, রসায়নে দুটিই বলা হয়, যদিও ফিজিক্সের ভাষায় বিদ্ঘুটে লাগছে! ) হচ্ছে, " কোন মৌলের প্রকৃতিতে প্রাপ্ত অ-তেজস্ক্রিয় আইসোটপগুলোর গড় ভর"।
অন্যদিকে ভর সংখ্যা হল পরমাণূর নিউক্লিয়াসে উপস্থিত নিউক্লিয়নের সংখ্যা ( প্রোটন+ নিউট্রন)
পারমাণবিক ভরের হিসাবঃ
প্রত্যেকটি আইসোটপের প্রাচুর্যতার শতকরা থেকে এটা হিসাব করা হয়। এটা সাধারণত দশমিক বিশিষ্ট সংখ্যা হয়, একেই পর্যায় সারণীতে মৌলের সাথে লেখা হয়।
আইসোটপদের প্রাচুর্যতার পারসেন্টেজকে তাদের নিজ নিজ ভর দ্বারা গুণ করে প্রাপ্ত সমষ্টিই হচ্ছে পারমাণবিক ভর।
তাহলে,
পারমাণবিক ভর = m1 × x1+ m2 × x2+m3 × x3+….+mn × xn
যেখানে ,
m1= প্রথম আইসোটপের ভর
x1 = প্রথম আইসোটপের প্রাচুর্যতা/ 100 ইত্যাদি
যেমন হাইড্রোজনের তিনটি প্রধান আইসোটপ 1H, 2H, এবং 3H। এদের প্রত্যেকের ভর সংখ্যা ভিন্ন।
প্রথমটিতে ১ টি প্রোটন আছে, কোন নিউট্রন নেই, তাই ভর সংখ্যা = (১+০)= ১
২য় টিতে ১ টি প্রোটন ও ১ টি নিউট্রন আছে। তাই ভরসংখ্যা (১+১) = ২।
একইভাবে ৩য় টির ভর সংখ্যা = ৩।
হাইড্রজনের মধ্যে ৯৯.৯৮ % হচ্ছে 1H, .০১৮% হচ্ছে 2Hএবং .০০২% হচ্ছে 3H।
উপরের সূত্রানুযায়ী হিসেব করলে উত্তর আসবে 1.0079 g/mol ।
প্রসঙ্গত, এখানে প্রাপ্ত পারমাণবিক ভর টি হল এক মোল পরিমাণ পদার্থের। তার মানে অ্যাভোগেড্রো সংখ্যক কণার বা 6.022×1023 গুলো কণার। একটি পরমাণূর ভর বের করতে হলে পারমানবিক ভরকে অ্যাভোগেড্রো সংখ্যা দ্বারা ভাগ দিতে হবে।

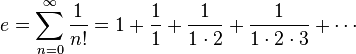


6 মন্তব্য(গুলি)
Write মন্তব্য(গুলি)অসাধারণ ব্যাখ্যা, অনেক উপকার হলো...
ReplySotti e upokrito holam
Replyভালো হয় নাই
ReplyValo ata
Replyভালো লেখা হয়নি
Replyপার্থক্য পাইনি
Reply